Đề cương ôn tập học kỳ I môn Hóa học Lớp 9
I. Thế nào là sự ăn mòn kim loại
- Sự phá hủy kim loại, hợp kim do tác dụng hóa học trong môi trường được gọi là sự ăn mòn kim loại.
II.Những yếu tố nào ảnh hưởng đến sự ăn mòn kim loại
1. Ảnh hưởng của các chất trong môi trường :
-Sự ăn mòn kim loại không xảy ra hoặc xảy ra nhanh hay chậm phụ thuộc vào thành phần của môi trường mà nó tiếp xúc.
2. Ảnh hưởng của nhiệt độ :
Nhiệt độ càng cao ,kim loại bị ăn mòn càng nhanh.
III. Làm thế nào để bảo vệ các đồ vật bằng kim loại không bị ăn mòn
- Ngăn không cho kim loại tiếp xúc với môi trường : sơn, mạ ,bôi dầu mỡ…
- Chế tạo hợp kim ít bị ăn mòn.
Bạn đang xem tài liệu "Đề cương ôn tập học kỳ I môn Hóa học Lớp 9", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề cương ôn tập học kỳ I môn Hóa học Lớp 9
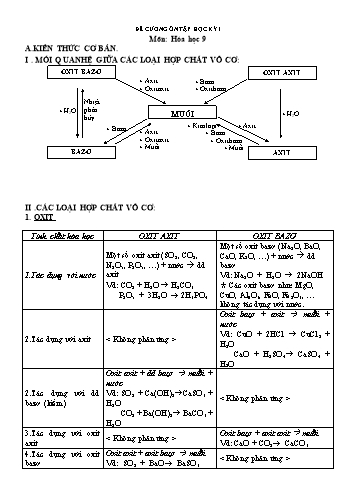
ĐỀ CƯƠNG ÔN TẬP HỌC KỲ I Môn: Hóa học 9 A.KIẾN THỨC CƠ BẢN. I . MỐI QUAN HỆ GIỮA CÁC LOẠI HỢP CHẤT VÔ CƠ: OXIT BAZƠ OXIT AXIT + Axit + Bazơ + Oxit axit + Oxit bazơ Nhiệt phân + H2O MUỐI + H O hủy 2 + Bazơ + Kim loại + Axit + Axit + Bazơ + Oxit axit + Oxit bazơ + Muối + Muối BAZƠ AXIT II .CÁC LOẠI HỢP CHẤT VÔ CƠ: 1. OXIT Tính chất hóa học OXIT AXIT OXIT BAZƠ Một số oxit bazơ (Na2O, BaO, Một số oxit axit (SO2, CO2, CaO, K2O, ) + nước dd N2O5, P2O5, ) + nước dd bazơ 1.Tác dụng với nước axit Vd: Na2O + H2O 2NaOH Vd: CO2 + H2O H2CO3 Các oxit bazơ như: MgO, P2O5 + 3H2O 2H3PO4 CuO, Al2O3, FeO, Fe2O3, không tác dụng với nước. Oxit bazơ + axit muối + nước Vd: CuO + 2HCl CuCl + 2.Tác dụng với axit 2 H2O CaO + H2SO4 CaSO4 + H2O Oxit axit + dd bazơ muối + nước 2.Tác dụng với dd Vd: SO + Ca(OH) CaSO + 2 2 3 bazơ (kiềm) H2O CO2 + Ba(OH)2 BaCO3 + H2O 3.Tác dụng với oxit Oxit bazơ + oxit axit muối axit Vd: CaO + CO2 CaCO3 4.Tác dụng với oxit Oxit axit + oxit bazơ muối bazơ Vd: SO2 + BaO BaSO3 Cu + 2AgNO3 Cu(NO3)2 + 2Ag Na2SO4 Lưu ý: Kim loại đứng trước (trừ K, Na, Điều kiện phản ứng xảy ra: Sản phẩm Ca, ) đẩy kim loại đứng sau (trong dãy phải có chất không tan. HĐHH của kim loại) ra khỏi dung dịch 4. Tác dụng với muối: muối của chúng. Muối + muối 2 muối mới 2. Tác dụng với axit: Vd: NaCl + AgNO3 AgCl + NaNO3 Muối + axit muối mới + axit mới Điều kiện phản ứng xảy ra: Sản phẩm Vd: BaCl2 + H2SO4 BaSO4 + 2HCl phải có chất không tan. Na2CO3 + 2HCl 2NaCl + H2O + CO2 5. Phản ứng nhiệt phân hủy: Điều kiện phản ứng xảy ra: Sản phẩm Một số muối bị phân hủy ở nhiệt độ cao: to phải có chất không tan hoặc chất khí. Vd: CaCO3 CaO + CO2 0 c) Phản ứng trao đổi: t Định nghĩa: Là phản ứng hóa học, trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới. Vd: a) BaCl2 + H2SO4 BaSO4 + 2HCl b)Na2CO3 + 2HCl 2NaCl + H2O + CO2 c) CuSO4 + 2NaOH Cu(OH)2 + Na2SO4 d)NaCl + AgNO3 AgCl + NaNO3 Điều kiện để phản ứng trao đổi xảy ra: Phản ứng trao đổi trong dung dịch của các chất chỉ xảy ra nếu sản phẩm tạo thành có chất không tan hoặc chất khí. Lưu ý: Phản ứng trung hòa cũng là phản ứng trao đổi và luôn xảy ra. Vd: NaOH + HCl NaCl + H2O III – KIM LOẠI: 1. TÍNH CHẤT CHUNG CỦA KIM LOẠI a) Tính chất vật lý:Có tính dẻo, dễ dát mỏng và dễ kéo sợi; có ánh kim;dẫn điện và dẫn nhiệt tốt. (Ag là kim loại dẫn điện và dẫn nhiệt tốt nhất, tiếp theo là Cu, Al, Fe, ) b) Tính chất hóa học: 1)Tác dụng với phi kim: Thường ở nhiệt độ 3)Tác dụng với muối: cao. Muối + kim loại muối mới + kim Với khí oxi: Tạo oxit. loại mới to Vd: 3Fe + 2O2 Fe3O4 Vd: Fe + CuSO4 FeSO4 + Cu Với các phi kim khác (Cl2, S, ): Tạo muối. Cu + 2AgNO3 Cu(NO3)2 + to to Vd: 2Na + Cl2 2NaCl ; Fe + S 2Ag FeS Lưu ý: Kim loại đứng trước (trừ K, 2)Tác dụng với dd axit: Na, Ca, ) đẩy kim loại đứng sau Kim loại đứng trước H (trong dãy HĐHH của (trong dãy HĐHH của kim loại) ra khỏi kim loại) + dd axit (HCl, H2SO4 loãng) dung dịch muối của chúng. muối + H2 * Lưu ý: Tác dụng với nước: Vd: 2Al + 3H2SO4loãng Al2(SO4)3 +3H2 Một số kim loại (Na, K, ...) + nước H2SO4 đặc, nóng và HNO3 tác dụng với hầu dd kiềm + H2 hết các kim loại (trừ Pt, Au) tạo thành muối Vd: 2Na +2H2O 2NaOH + H2 nhưng không giải phóng hidro SO SÁNH TÍNH CHẤT CỦA NHÔM VÀ SẮT: Tính chất NHÔM (Al = 27) SẮT (Fe = 56) to to 3CO + Fe2O3 3CO2 + FeO + C Fe + CO 2Fe 4.Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn I. Thế nào là sự ăn mòn kim loại - Sự phá hủy kim loại, hợp kim do tác dụng hóa học trong môi trường được gọi là sự ăn mòn kim loại. II.Những yếu tố nào ảnh hưởng đến sự ăn mòn kim loại 1. Ảnh hưởng của các chất trong môi trường : -Sự ăn mòn kim loại không xảy ra hoặc xảy ra nhanh hay chậm phụ thuộc vào thành phần của môi trường mà nó tiếp xúc. 2. Ảnh hưởng của nhiệt độ : Nhiệt độ càng cao ,kim loại bị ăn mòn càng nhanh. III. Làm thế nào để bảo vệ các đồ vật bằng kim loại không bị ăn mòn - Ngăn không cho kim loại tiếp xúc với môi trường : sơn, mạ ,bôi dầu mỡ - Chế tạo hợp kim ít bị ăn mòn. ĐỀ 1 A.Trắc Nghiệm: Khoanh tròn vào chữ cái A, B, C hoặc D đứng trước câu trả lời mà em cho là đúng Câu 1: Dãy các kim loại nào sau đây được sắp xếp đúng theo chiều hoạt động hóa học giảm dần? A. K, Mg, Zn, Ag.B. K, Ag, Mg, Zn C. Zn, K, Ag, Mg. D. Mg, Zn, K, Ag Câu 2: Cặp chất nào dưới đây có thể tác dụng được với dung dịch NaOH ? A. CaO, MgO. B. KOH, Ba(OH)2.C. Fe 2O3, CO. D. CO2, SO2. Câu 3: : Cặp chất nào sau đây không xảy ra phản ứng: A. Fe và Cl2 B. Zn và Cu(NO3)2 C. Fe và H2SO4đặc,nguội D. Cu(OH)2 và HCl Câu 4: Chất có thể tác dụng với nước tạo thành dung dịch làm cho phenolphtalêin không màu hóa thành hồng là: A: K2O B: SO3 C: ZnO D: MgO Câu 5: Cho 0,1 mol dung dịch NaCl tác dụng vừa đủ với dung dịch AgNO3 thu được kết tủa trắng AgCl. Khối lượng kết tủa là A. 14,35g. B. 15,35g. C. 16,35g. D. 17g. Câu 6: Hiện tượng xảy ra khi cho Al vào ống nghiệm chứa sẵn 2ml dung dịch NaOH A. có khí không màu thoát ra, nhôm tan dần.B. nhôm tan dần, có kết tủa trắng. C. xuất hiện dung dịch màu xanh. D. không có hiện tượng xảy ra. Câu 7: Chất nào sau đây được dùng làm nguyên liệu ban đầu để sản xuất axit H2SO4 trong công nghiệp? A. SO3. B. FeS . C. SO2 . D. S. Câu 8: Cặp chất nào sau đây có phản ứng tạo thành sản phẩm là chất khí? A. Dung dịch Na2SO4 và dung dịch BaCl2. B. Dung dịch KCl và dung dịch AgNO3. C. Dung dịch KOH và dung dịch MgCl2. D. Dung dịch Na2CO3 và dung dịch HCl. Câu 9: : Dãy kim loại nào sau đây tác dụng được với dd HCl tạo thành muối và giải phóng khí H2? A. Cu, Zn, Fe. B. Pb, Al, Fe. C. Pb, Zn, Cu. D. Mg, Fe; Ag. Câu 5: Dãy các kim loại đứng trước hiđro trong dãy hoạt động hóa học của kim loại là: A. Na, K, Ca, Zn, Cu, Ag. B. K, Ca, Mg, Al, Fe, Au. C. K, Na, Mg, Zn, Fe, Al. D. Na, K, Ca, Mg, Al, Cu. Câu 6: Cặp kim loại không tác dụng với H2SO4 đặc, nguội là A. Fe, Cu. B. Al, Fe. C. Al, Mg. D. Mg, Ag. Câu 7:Công thức hóa học của urê là: A. (NH4)2SO4 B. NH4NO3 C. Ca(NO3)2 D. CO(NH2)2 Câu 8: Một dung dịch Cu(NO3)2 có lẫn AgNO3 người ta có thể dùng kim loại nào sau đây để làm sạch dung dịch Cu(NO3)2 A. Cu B. Fe C. Al D. Au . Câu 9: Nối cột A với cột B cho phù hợp: Cột A Cột B 1. Fe + HCl a. Cu(NO3)2 + Ag 2. Cu + AgNO3 b. MgS 3. Mg + S c. FeCl3 4. Fe + Cl2 d. FeCl2 + H2 1, 2- .., 3-, 4- .. B.Tự luận Câu 1: ( 1) Từ các chất: Fe, Cu(OH)2, HCl, Na2CO3, hãy viết các PTHH điều chế: a) Dd FeCl2. b) Dd CuCl2. c) Khí CO2. d) Cu kim loại. (2) Hãy nêu phương pháp hóa học để nhận biết các kim loại sau: a) Al, Zn, Cu. b) Fe, Al, Ag, Mg. Câu 2 :Cho các chất sau: Na2O, Na, NaOH, Na2SO4, Na2CO3, NaCl. a) Hãy sắp xếp các chất trên thành một dãy chuyển hóa hóa học. b) Viết các phương trình phản ứng cho dãy chuyển hóa đó. Câu 3:Trung hòa dd KOH 5,6% (D = 10,45g/ml) bằng 200g dd H2SO4 14,7%. a) Tính thể tích dd KOH cần dùng. b) Tính C% của dd muối sau phản ứng. Câu 4:SO2 là một trong các chất chủ yếu gây ô nhiễm môi trường nhưng có nhiều ứng dụng : dùng để sản xuất axit sunfuric, tẩy trắng giấy, bột giấy, chống nấm mốc cho lương thực, thực phẩm . Trong công nghiệp SO2 được điều chế từ các nguyên liệu khác nhau như lưu huỳnh, đốt quặng sunfua kim loại như pirit sắt (FeS2). Em hãy viết phương trình phản ứng điều chế SO2 và cho biết ưu, nhược điểm đối đối với môi trường của 2 loại nguyên liệu trên? ĐỀ 3 A.Trắc Nghiệm: Khoanh tròn vào chữ cái A, B, C hoặc D đứng trước câu trả lời mà em cho là đúng Câu 1: Dãy Oxit nào sau đây sẽ tác dụng với Axit A.CaO ,K2O, MgO, Fe2O3, SO2 B.CuO ,BaO, ZnO, Na2O, Mg C. SO3, Fe2O3, NO2, K2O, Na2O D.Fe2O3, CuO, BaO, ZnO, MgO, SO2 Câu 2: Dãy các dung dịch muối nào sau đây đều tác dụng với dung dịch NaOH A.KNO3, Na2SO4, MgCl2 B.K2SO4 , FeSO4, MgSO4 C.FeCl3, CuCl2, MgSO4 D.BaCl2, Cu(NO3)2,FeCl3 Câu 3: Có các hợp chất Oxit sau :SiO2, CO2, SO2, SO3. Chúng thuộc loại hợp chất Oxit gì A.Oxit bazơ B. Oxit axit C.Oxit lưỡng tính D. Oxit trung tính sunfuric (H2SO4) và axit nitric(HNO3). Khi trời mưa, các hạt axit này tan lẫn vào nước mưa, làm độ pH của nước mưa giảm. Nếu nước mưa có độ pH dưới 5,6 được gọi là mưa axit. Mưa axit ảnh hưởng xấu tới các thuỷ vực (ao, hồ). Các dòng chảy do mưa axit đổ vào hồ, ao sẽ làm độ pH của hồ giảm xuống, lượng nước trong ao hồ sẽ giảm đi nhanh chóng, các sinh vật trong hồ, ao suy yếu hoặc chết hoàn toàn. Hồ, ao trở thành các thuỷ vực chết.Mưa axit ảnh hưởng xấu tới đất do nước mưa ngấm xuống đất làm tăng độ chua của đất, hòa tan các nguyên tố trong đất cần thiết cho cây như canxi (Ca), magie (Mg) làm suy thoái đất, cây cối kém phát triển. Lá cây gặp mưa axit sẽ bị "cháy" lấm chấm, mầm sẽ chết khô, làm cho khả năng quang hợp của cây giảm, cho năng suất thấp.Mưa axit còn phá huỷ các vật liệu làm bằng kim loại như sắt, đồng, kẽm,... làm giảm tuổi thọ các công trình xây dựng, làm lở loét bề mặt bằng đá của các công trình.Hầu hết tất cả, mưa axit ảnh hưởng xấu đến sức khỏe con người. Nó có thể làm hại chúng ta thông qua không khí và ô nhiễm đất. a)Hãy cho biết mưa axit là loại nước mưa như thế nào? Nguyên nhân chính nào gây ra mưa axit là gì? b)Hãy cho biết tác hại của mưa axit? ĐỀ 4 A.Trắc Nghiệm: Khoanh tròn vào chữ cái A, B, C hoặc D đứng trước câu trả lời mà em cho là đúng Câu 1: Một chất khí X có các tính chất sau: Nặng hơn không khí. Không duy trì sự cháy. Làm đục nước vôi trong. Chất khí X có thể là: A. Cl2 B. O2 C. CO2 D. SO2 Câu 2: Một chất khí Ycó các tính chất sau:Không màu, rất độc.Cháy trong không khí với ngọn lửa xanh và sinh ra chất khí làm đục nước vôi trong. Chất khí Y có thể là: A. Cl2 B. H2 C. CO2 D. CO (1) (2) (3) (4) Câu 3: Cho một chuỗi biến hóa: MnO2 Cl2 FeCl3 NaCl NaOH. Các chất phản ứng lần lượt trong chuỗi biến hóa là: A. HCl, NaOH, H2O, Fe B. HCl, Fe, NaOH, H2O C. MnCl2, Fe, NaOH, H2 D. MnCl2, Fe, H2O, NaOH Câu 4: Nung 1,5 tấn CaCO3, thu được 672 kg CaO. Hiệu suất của phản ứng là: A. 60% B. 70% C. 80% D. 90% Câu 5: Cho 1,12 lít khí clo (đktc) vào trong dung dịch NaOH 1M. Sau khi phản ứng kết thúc, thể tích dung dịch NaOH cần dùng là: A. 0,1 lít B. 0,12 lít C. 0,15 lít D. 0,2 lít Câu 6: Cho 21g MgCO3 tác dụng với một lượng vùa đủ dung dịch HCl 2M. Khí sinh ra được dẫn vào dung dịch nước vôi trong có dư, thu được một chất kết tủa. Khối lượng kết tủa là: Câu 9: Nối thông tin ở hai cột cho phù hợp (một thông tin có thể nối với nhiều thông tin ở cột còn lại). A. 35g B. 30g C. 25g D. 20g
File đính kèm:
 de_cuong_on_tap_hoc_ky_i_mon_hoa_hoc_lop_9.docx
de_cuong_on_tap_hoc_ky_i_mon_hoa_hoc_lop_9.docx

