Đề cương ôn tập kiểm tra học kỳ I môn Hóa học Lớp 9 - Năm học 2019-2020 - Trần Dũng Chinh
1. Viết PTHH theo chuỗi phản ứng:
Viết PTHH xảy ra khi:
1. Cho bột CuO vào dd axit clohidric
2. Dẫn khí cacbonic vào dd nước vôi trong.
3. Cho một mẫu canxi oxit vào cốc nước
4. Nhiệt phân một mẫu đá vôi
5. Cho từ từ dd axit sunfuric vào ống nghiệm chứa Cu(OH)2
6. Đun nóng một mẫu Cu trong axit sunfuric đặc.
7. Đốt nóng một đoạn dây sắt rồi đưa vào bình đụng khí clo.
8. Ngâm một dây kẽm trong dung dịch CuCl2
9. Trộn dd Na2CO3 với dd H2SO4.
10. Cho 1 ít Fe2O3 vào dd axit clohidric.
11. Khí O2 có lẫn hơi nước, để làm khô khí O2, ta có thể dùng chất nào?
2. Dạng bài tập nhận biết chất:
Bạn đang xem tài liệu "Đề cương ôn tập kiểm tra học kỳ I môn Hóa học Lớp 9 - Năm học 2019-2020 - Trần Dũng Chinh", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề cương ôn tập kiểm tra học kỳ I môn Hóa học Lớp 9 - Năm học 2019-2020 - Trần Dũng Chinh
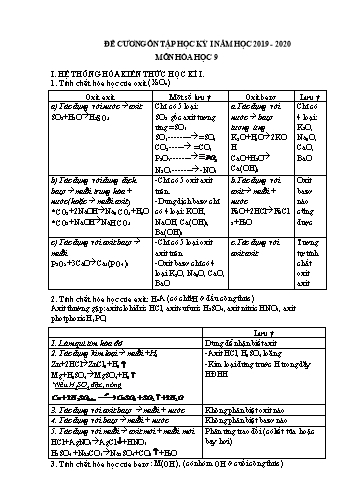
ĐỀ CƯƠNG ÔN TẬP HỌC KỲ I NĂM HỌC 2019 - 2020 MÔN HÓA HỌC 9 I. HỆ THỐNG HÓA KIẾN THỨC HỌC KÌ I. 1. Tính chất hóa học của oxit (X2On) Oxit axit Một số lưu ý Oxit bazơ Lưu ý a) Tác dụng với nước axit Chỉ có 5 loại: a.Tác dụng với Chỉ có SO2+H2O H2SO3 SO2 gốc axit tương nước bazơ 4 loại: ứng =SO3 tương ứng K2O, SO3--------- =SO4 K2O+H2O 2KO Na2O, CO2------ =CO3 H CaO, P2O5-------- PO4 CaO+H2O BaO N2O5-------- -NO3 Ca(OH)2 b) Tác dụng với dung dịch -Chỉ có 5 oxit axit b.Tác dụng với Oxit bazơ muối trung hòa + trên. axit muối + bazơ nước(hoặc muối axit) -Dung dịch bazơ chỉ nước nào *CO2+2NaOH Na2CO3+H2O có 4 loại: KOH, FeO+2HCl FeCl cũng *CO2+NaOH NaHCO3 NaOH, Ca(OH)2, 2+H2O được Ba(OH)2 c) Tác dụng với oxit bazơ -Chỉ có 5 loại oxit c.Tác dụng với Tương muối axit trên oxit axit tự tính P2O5+3CaO Ca3(PO4)2 -Oxit bazơ chỉ có 4 chất loại K2O, Na2O, CaO, oxit BaO axit 2. Tính chất hóa học của axit: HnA (có chữ H ở đầu công thức) Axit thường gặp: axit clohiđric HCl, axit sufuric H2SO4, axit nitric HNO3, axit photphoric H3PO4 Lưu ý 1. Làm quì tím hóa đỏ Dùng để nhận biết axit 2. Tác dụng kim loại muối +H2 -Axit HCl, H2SO4 loãng Zn+2HCl ZnCl2+H2 -Kim loại đứng trước H trong dãy Mg+H2SO4 MgSO4+H2 HĐHH *Nếu H2SO4 đặc, nóng t0 Cu 2H2SO4dac CuSO4 SO2 2H2O 3. Tác dụng với oxit bazơ muối + nước Không phân biệt oxit nào 4. Tác dụng với bazơ muối + nước Không phân biệt bazơ nào 5. Tác dụng với muối axit mới + muối mới Phản ứng trao đối (có kết tủa hoặc HCl+AgNO3 AgCl +HNO3 bay hơi) H2SO4 +Na2CO3 Na2SO4+CO2 +H2O 3. Tính chất hóa học của bazơ: M(OH)x (có nhóm OH ở cuối công thức) 1. Tác dụng với kim loại Clo tác dụng với Fe thì Fe có hóa trị III +oxit tác dụng KL oxit (cao nhất) +PK khác tác dụng KL muối 2. Tác dụng với hiđrô hợp chất khí t0 Cl2+H2 2HCl 3. Tác dụng với oxi oxit axit Clo không phản ứng với oxi t0 S+O2 SO2 *chú ý +Clo phản ứng với nước: Cl2+H2O HCl+HClO +Clo phản ứng với NaOH Cl2+2NaOH NaCl+NaClO+H2O(nước Giaven) II. BÀI TẬP: 1. Viết PTHH theo chuỗi phản ứng: a) b) CaSO3 CaCl2 4 5 1 2 3 4 1 2 3 S SO2 H2SO3 Na2SO3 SO2 CaCO3 CaO Ca(OH)2 CaCO3 6 5 Na2SO3 c) ( 6 ) (7 ) ( 8 ) 1 2 3 4 5 Na Na2O NaOH Na2CO3 Na2SO4 NaCl (9) (10) (11) d) 4 1 2 3 K K2O KOH K2SO4 5 6 7 8 9 K2CO3 KCl KNO3 e) 1 2 3 4 5 6 Al Al2O3 AlCl3 Al(OH )3 Al2O3 Al AlCl3 1 2 3 4 5 g) Fe FeSO4 Fe(OH )2 FeCl2 Fe(NO3 )2 Fe 1 2 3 4 5 6 7 8 h) Fe FeCl3 Fe(NO3)3 Fe(OH)3 Fe2(SO4)3 FeCl3 Fe(OH)3 Fe2O3 Fe Viết PTHH xảy ra khi: 1. Cho bột CuO vào dd axit clohidric b) Dung dịch A tác dụng vừa đủ với 200 ml dd NaOH tạo ra a gam kết tủa. Tính a và CM của dd NaOH. Bài 3. Cho khí SO2 tác dụng với 400ml dd KOH 0,5M. Tính: a) Thể tích khí SO2 (đktc) vừa đủ tạo ra muối axit và nồng độ mol của dd sau phản ứng. b) Thể tích khí SO2 (đktc) vừa đủ tạo ra muối trung hòa và nồng độ mol của dd sau phản ứng. 4. Dạng bài tập hỗn hợp chất: Nếu 1 trong 2 chất, có 1 chất không phản ứng thì bài toán đơn giản hơn. Chỉ cần tính khối lượng chất phản ứng, lấy tổng khối lượng trừ đi khối lượng chất phản ứng, ta tính được lượng chất không phản ứng (hoặc ngược lại). Nếu cả 2 chất phản ứng thì giải bài toán lập hệ phương trình. Bài 1. Cho 10,5g hỗn hợp 2 kim loại Zn và Cu vào dd H2SO4 loãng dư, thu được 2,24 lít khí H2 (đktc). Tính khối lượng chất rắn còn lại sau phản ứng. Bài 2. Cho 1,41g hỗn hợp nhôm và sắt tác dụng với dd H2SO4 loãng dư, sau phản ứng thu được 1,568 lít khí (đktc). Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp. Bài 3. Hòa tan hoàn toàn 7,8g hỗn hợp bột nhôm và nhôm oxit bằng dd HCl 3M, thu được 3,36 lít khí (đktc). Hãy tính: a) Thành phần % khối lượng mỗi kim loại. b) Thể tích dd axit cần dùng. Bài 4. hòa tan 17,6g hỗn hợp gồm MgCO3 và CaCO3 vào dd H2SO4 0,5M thì thu được 4,48 lít khí CO2 (đktc). a)Tính % về khối lượng hỗn hợp muối ban đầu. b) Tính thể tích dd H2SO4 đã dùng. Bài 5. để xác định % khối lượng mỗi chất của hỗn hợp Al và Mg, người ta làm 2 thí nghiệm sau: -Thí nghiệm 1. cho m gam hỗn hợp tác dụng với dd H2SO4 loãng dư thu được 1568 ml khí (đktc). -Thí nghiệm 2.cho m gam hỗn hợp tác dụng với dd NaOH dư phản ứng xonh thấy còn lại 0,6 g chất rắn. Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp. 5. Dạng bài tập có dư chất tham gia: Bài 1. Cho 8 g CuO tác dụng với 100g dd axit H2SO4 24,5%. Tính nồng độ phần trăm các chất có trong dd sau khi phản ứng kết thúc. Bài 2. Trộn 50ml dd Na2SO4 0,5M với 100ml dd BaCl2 0,1M. hãy tính: a/ khối lượng kết tủa sinh ra. b/ nồng độ mol của mỗi chất trong dd sau phản ứng.( giả sử thể tích không thay đổi). Bài 3. trộn 30g dd BaCl2 20,8% với 20g dd H2SO4 19,6% thu được a gam kết tủa A và dd B. Tính a và nồng độ % các chất trong dd B. Tính khối lượng dd NaOH 5M (D=1,2g/ml) cần dùng để trung hòa vừa đủ ddB.
File đính kèm:
 de_cuong_on_tap_kiem_tra_hoc_ky_i_mon_hoa_hoc_lop_9_nam_hoc.doc
de_cuong_on_tap_kiem_tra_hoc_ky_i_mon_hoa_hoc_lop_9_nam_hoc.doc

